
Hace un
tiempo se consideraba a los humanos como islas fisiológicas con capacidad de
regular su funcionamiento interno.

En el último decenio se ha demostrado que el cuerpo humano no es
tan auto suficiente. Más bien se asemeja
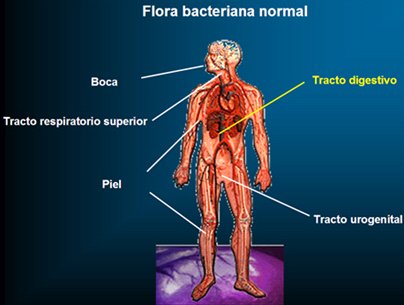
a un complejo ecosistema o red social que contiene billones de bacterias y
otros microorganismos que habitan en la piel, las zonas genitales, la boca y
sobre todo, los intestinos.

La mayoría
de las células del cuerpo humano no son humanas. Las células bacterianas que
albergamos en nuestro interior superan a las humanas en una proporción de 10 a
1.
La comunidad
mixta de microorganismos y de genes, denominada microbioma, no nos amenaza,
sino que nos ofrece una ayuda vital en los procesos biológicos básicos; la
digestión, el crecimiento y la inmunidad.

Al
hablar de los microbios del cuerpo, la gente suele pensar en agentes patógenos.
Como nos resultan ajenos y los adquirimos a lo largo de la vida, no significa
que constituya una parte menos importante de nosotros.

Debido a que
el útero suele carecer de bacterias, los recien nacidos comienzan su vida como
seres estériles. Pero a medida que atraviesan el canal del parto recogen
algunas células comensales de la madre, que a continuación comienzan a
multiplicarse.
La lactancia materna y el manoseo de los padres, abuelos,
hermanos y amigos, por no mencionar el contacto con las sabanas, mantas,
mascotas, contribuye de forma rápida a la expansión de los microorganismos.
Las células
bacterianas de los intestinos, por ejemplo, han evolucionado para crecer en el
entorno concurrido y carente de oxigeno del intestino, por que numerosas
especies no sobreviven en la extensión solitaria de una placa de Petri.
Mediante la determinación de la secuencia de este gen se está creando un catalogo del microbioma
humano.
Tal información permite deducir las especies que viven en
nuestro cuerpo y la variación en la composición especifica entre personas.
El siguiente paso consiste en identificar cuales presentan
actividad en la personas y que funciones
desempeñan.
Determinar si un gen bacteriano concreto se halla activo (o se
expresa) en el cuerpo resulta sencillo, pero averiguar a que especie pertenece
no lo es.
Dos
grupos científicos, uno de EEUU y otro de Europa, han aprovechado esta nueva técnica
para enumerar los genes bacterianos del cuerpo humano.
A
principios de 2010, el equipo europeo
publicó el censo de genes microbianos del sistema digestivo humano; 3,3
millones de genes (pertenecientes a más de 1000 especies), una cifra 150
superior a la del genoma humano, formado por entre 20.000 y 25.000 genes.
No hay dos
personas con la misma composición microbiana, ni siquiera dos gemelos idénticos.
Un
enigma que surgió a raíz del proyecto del Genoma Humano; el 99.9 % de
coincidencia en el ADN de todas las personas del Mundo.

El
destino individual, la salud y tal vez, algunas de nuestras acciones, pueden
tener mucho que ver con la variación en los genes de nuestro microbioma que con
los de nuestro propio organismo.
Incluso las bacterias mas ventajosas pueden causar una
enfermedad grave si ocupan un lugar inadecuado, como la sangre (donde ocasiona
septicemia) o el entramado de tejido entre los órganos abdominales (donde
provocan peritonitis).
Se ha
comprobado que dos especies de comensales desempeñan funciones esenciales en la
digestión y en la regulación del apetito.
El microbio Bacteroides
Thetaitomicron descompone las moléculas largas y complejas de los Hidratos
de Carbono que se hallan en muchos alimentos vegetales y los convierte en
Glucosa y otros azucares pequeños, simples y fáciles de digerir.
El
Genoma Humano, posee genes que codifican más de 260 enzimas que digieren el
material vegetal, lo que ofrece a los humanos, la posibilidad de extraer
nutrientes de naranjas, manzanas, patatas y germen de trigo, entro otros
alimentos.

En
2005, un equipo de la Universidad DE
Washington, en San Luís, informó que la B. Thetaitomicron
sobrevive a base de Hidratos de Carbono complejos, los polisacáridos; fermenta
esas sustancias y genera ácidos grasos de cadena corta(en esencia sus productos
de desechos), que los ratones utilizan como combustible.
Los microorganismos rescatan
así calorías de forma no digeribles de Hidratos de Carbono, tales como la Fibra Alimentaria
Según
Martin Blazer, profesor de medicina interna y microbiológica de la Universidad de Nueva York,
se sabe desde hace años que el estomago produce dos hormonas implicadas en el
apetito; la Grelina y la Leptina.

La Leptina informa al cerebro que el
estomago esta lleno y no necesita mas comida.
La sensación de hambre cuando nos levantamos por la mañana se
debe al aumento del nivel de Grelina. Su valor disminuye tras haber comido en
el desayuno, fenómeno pospandrial (prandium = comida)
El año pasado Blazer y sus colaboradores examinaron los valores
de Grelina y Leptina antes y después de las comidas en personas con y sin
H.Pylori. Los resultados fueron claros; cuando el estomago albergaba H.Pylori
se produce un descenso pospandrial de la Grelina ; sin la bacteria, tal descenso no tenía
lugar.
Ello hace pensar que H. Pylori interviene en la regulación de la
grelina y por lo tanto, del apetito, aunque el modo en que lo hacen sigue
siendo un misterio.
El
estudio realizado con 98 exmilitares, demostró que quienes se trataron con antibióticos
para eliminar H.Pylori ganaron mas peso que sus compañeros no infectados. Su nivel de Grelina
se mantuvo elevado cuando debería haber descendido, lo que les provoco hambre
durante más tiempo y les hizo comer más.
Por otra parte los niños expuestos de forma continua a dosis
alta de antibióticos tienden a experimentar otros cambios en su composición
microbiana.
Blazer
conjetura que la administración generalizada de antibióticos a los niños
pequeños ha ocasionado alteraciones en la composición de su mirobioma
intestinal y que tal fenómeno contribuye a explicar la creciente Obesidad
Infantil.
Según él, las distintas bacterias determinarían que ciertas células
madre del cuerpo se diferenciaran en células adiposas, musculares u óseas.
¿Podría la pérdida progresiva de H. Pylory y otras bacterias del
microbioma humano, junto con los hábitos sociales (la fácil disponibilidad de
alimento de alto contenido calórico y la continua disminución de actividad física)
inclinar la balanza hacia una epidemia Mundial de Obesidad?
No sólo el tratamiento con antibióticos constituye la única
causa de la alteración del microbioma humano, ya que también es debido al aumento de espectacular del numero de
partos por cesárea en estos últimos años, ha reducido la transferencia de cepas
muy importantes de la madre al hijo a través del canal del parto.
También debido, que hasta
el agua mas limpia que tengamos, se esta cobrando un peaje en el microbioma
humano, al reducir la variedad de las bacterias a las que nos exponemos.
Como resultado, un número creciente de personas nacen y crecen en un mundo
microbiano cada vez mas empobrecido.
Actualmente con los datos que tenemos se sugiere la idea de que existe un equilibrio entre las células del microbioma y las del sistema
inmunitario que ha tardado unos 200.000 años en calibrarse.
A lo largo del
tiempo ese sistema ha desarrollado numerosos controles y ajustes para evitar
volverse demasiado agresivo (lo que le haría atacar a sus propios tejidos o demasiado laxo (lo que le
impediría reconocer los patógenos peligrosos).
Los
Linfocitos T desempeñan una importante función al identificar y atacar a los
invasores microbianos del cuerpo; además, desencadenan hinchazón,
enrojecimiento y aumento de la temperatura, reacciones caracterisitcias de las
respuesta inflamatoria ante una infección. Después
el cuerpo empieza a generar otras células, los Linfocitos T Reguladores, con el
objetivo de contrarrestar la actividad de los primeros, los Linfocitos T
Pro-inflamatorios.
Los Linfocitos T reguladores suelen entrar en acción antes que
los Proinflamatorios hayan proliferado en exceso.
Los
Linfocitos T reguladores producen una proteína que frena a los
Proinflamatorios. Mientras haya un buen equilibrio entre ambos tipos de
Linfocitos, el cuerpo permanecerá en buen estado de salud.
Mazmanian
y otros están empezando a demostrar que un sistema inmunitario sano y maduro
depende la intervención constante de bacterias beneficiosas.
La
fuerza impulsora que ha conferido las características a este sistema se halla
en los comensales.
El
equipo de Mazmanian ha descubierto que Bacteroides Fragilis, un microorganismo común
presente en un 70 u 80 % de las personas, ayuda a mantener el equilibrio
inmunitario al favorecedor las reacciones antiinflamatorias.
Las cepas de
Bacteroides Fragilis que carecen del polisacárido A simplemente no sobreviven
en al mucosas intestina, donde las células del sistema inmunitario atacan a los
microbios como si de un patógeno se tratara.

En 2011, Mazmanian describían la ruta molecular para el mutualismo
entre un microbio y un mamífero. B. Fragilis cumple una importante misión que
nuestro propio ADN no nos proporciona. Podría decirse que se apodera de nuestro
sistema inmunitario.
Sin embargo a diferencia de los microorganismos patógenos, tal
secuestro no inhibe el sistema inmunitario, sino que lo ayuda a funcionar.
En nuestro esfuerzo por distanciarse de los agentes infecciosos
que nos provocan enfermedades hemos alterado la relación con el microorganismo
que nos resulta útil. Nuestras intenciones son buenas, pero hay un precio que
pagar.
En el
caso de B.Fragilis, el precio puede ser una mayor incidencia de los trastornos
autoinmunitarios.
Si el polisacárido A que señalice el sistema inmunitario para
que produzcan mas linfocitos T reguladores, los Linfocitos t Beligerantes
empiezan a atacar a todo lo que encuentran por delante, incluido nuestros
tejidos.

Mazmanian
sostiene que el aumento reciente de entre 7 y 8 veces en la frecuencia de los
trastornos autoinmunitarios, como al Enfermedad de Crohn, la Diabetes tipo I y la Esclerosis Múltiple
Todas
estas enfermedades presentan un componente genético y otro ambiental.
O bien la perdida de la Flora Microbianala Obesidad , o bien el
aumento de ambos tratarnos ha creado un ambiente desfavorable para los
microorganismos beneficiosos de nuestro cuerpo.
Mazmanian se decanta
por la primera opción.

Se
deberá demostrar la existencia de causa y efecto mediante la aclaración de los mecanismos que dan lugar
a esa correlación.
Ahí está el futuro de las investigaciones….










